編者按:
研究發現,健康的腸道菌群似乎是腫瘤免疫療法所需要的,因為其或可提高機體對腫瘤的免疫應答。一些研究人員認為基於微生物組的療法可以幫助更多的患者對免疫療法作出響應,並相信這一療法將成為癌症治療領域幾十年來最大的突破之一。今天,我們共同關注微生物與癌症,特別編譯了發表在Science 雜誌上題為“Can patients'gut microbes help fight cancer?”的文章。希望本文能夠為相關的產業人士和諸位讀者帶來一些幫助和啟發。
腸道菌群與免疫
腸道菌群在免疫系統應答中起著重要作用,乍一看,這似乎有些奇怪。但是,考慮到我們絕大多數的免疫細胞(高達70%~80%)都在腸道中活動,這就不再奇怪了。腸道作為人體巨大的“運輸樞紐”,免疫細胞直接暴露於外部世界以及具有令人難以置信的基因多樣性的腸道微生物組中。腸道微生物組由數以萬億計的細菌細胞組成,在幫助人體消化、合成維生素和其他營養物質的同時,它們也會排出代謝產物。流動的免疫細胞可以確保有益微生物和宿主細胞能夠耐受“入侵者”。
儘管分子上的細節還遠未被完全了解,但是已經明確的是,擁有健康的腸道微生物組可以確保T 細胞廣泛地啟動對抗抗原,並被激活為細胞毒性CD8+ T 細胞,浸潤並攻擊腫瘤細胞。
免疫檢查點抑製劑(CPI)療法的進展表明,當檢查點或製動器(brakes)脫離細胞毒性T 細胞時,甚至轉移性腫瘤也可以縮小和控制。然而,腫瘤學家沮喪地發現,只有少數患者(通常不到30%~40%)對CPI 療法有應答。
目前,研究表明,當使用CPI 療法(例如抗PD -1、抗PD - L1 和抗CTLA -4 免疫療法)時,健康、多樣的腸道微生物組可使患者產生更好的應答。因此,弄清楚是哪些微生物(或哪些代謝產物或產物),塑造了這些免疫應答,已經成為該領域研究人員之間的競爭點。
這些“微生物管理者”希望能找到方法來觸發、改變或推動病人的菌群,以激活對抗腫瘤的T 細胞,從而將更多的病人轉化為CPI 應答者。
“越來越多的文獻開始關注腸道菌群在校準系統免疫應答中的作用。” 明尼阿波里斯市明尼蘇達大學微生物治療項目主任Alexander Khoruts 說。他是腸胃病學的先驅者之一,他首先使用了糞菌移植(FMT)來治療復發性艱難梭菌感染的患者。
發現腸道和癌症的關聯
2013 年,在法國維勒瑞夫的古斯塔夫·魯西癌症園區的Laurence Zitvogel 和她的研究小組得出結論,腸道菌群喪失或缺失的小鼠對化療的免疫響應比菌群完整無缺的小鼠弱[1]。這是一個如此新穎的想法,以至於立刻引起了懷疑。馬薩諸塞州劍橋市Vedanta Biosciences 公司首席執行官Bernat Olle 回憶起當時的想法:“嗯,我不知道我是否相信。” 他說,癌症被認為是基因組和突變不斷積累的疾病。“但是,我們現在知道癌症也是一種涉及無效免疫應答的疾病。”
Zitvogel 小組在2015 年的工作說服了Bernat Olle,並正式開啟了這一領域的研究。當他們用ipilimumab 藥物治療小鼠的腫瘤時,他們發現CPI 可以控制具有正常腸道菌群的無病原體小鼠的腫瘤,但是沒有腸道菌群的無菌小鼠的腫瘤卻無法被控制[2 ]。關鍵的一點是,將有益菌種移植回這些老鼠體內,可以恢復CPI 的抗癌活性。
Vedanta 公司的科學共同創始人Kenya Honda 是日本埼玉縣RIKEN 綜合醫學中心的負責人,他發現CD8+ 細胞毒性T 細胞的誘導發生在腸道中,並且取決於微生物組的存在[3]。
“很明顯,我對Zitvogel 的創新發現的第一反應是錯誤的。” Bernat Olle 說。他回憶道,僅僅10 年前,我們還認為免疫系統的功能就是區分自我與非自我之間的差異。但是Bernat Olle 現在認為,它的作用應該是更廣泛的——它進行分類,對攻擊誰和容忍誰做出快速決定。
“也許免疫系統更像是人體中的園丁,決定哪些雜草必須被拔掉並扔掉,哪些雜草可以留在草坪上。”
在Zitvogel 組的創新性發現之後,有許多研究表明,接受廣泛抗生素治療(被認為可以減少腸道微生物)的患者對CPIs 反應不佳[4,5],對疫苗的適應性免疫應答更差[ 6]。
微生物組影響T 細胞,進而影響癌症免疫治療的潛在機制之一,是通過大量腸道代謝物來充當免疫調節信號。“T 細胞可以從腸道中的細菌那裡得到馴化,然後每天多次循環到身體的其他部位,” Bernat Olle 說,“腸道內發生的事情會影響整個免疫系統。”
微生物組和T細胞之間的黑匣子
微生物組、它們的代謝物、T 細胞和其他免疫細胞之間的相互作用究竟是如何精確地展開的,這在很大程度上仍然是個謎。“某些細菌的存在會影響活化的細胞毒性CD8+ 細胞的平衡。”亞利桑那州弗拉格斯塔夫轉化基因組學研究所的微生物基因組科學家Sarah Highlander 說。
但研究人員仍然需要確定哪些有益細菌必須存在,以及它們如何在分子水平上激活T 細胞。Highlander 和她的合作者Sumanta Pal(加利福尼亞州杜阿爾特市希望之城癌症中心的醫學腫瘤學家),已經對接受抗PD-1 CPI 治療的患者的微生物組進行了縱向跟踪。
他們發現,與無響應者相比,對CPI 做出響應的轉移性腎細胞癌患者其微生物多樣性更加高,尤其是Akkermansia muciniphila 的豐度增加[7]。
在Sumanta Pal 看來,腸道上皮細胞會通過分泌炎症細胞因子來對某些鄰近的微生物做出應答,從而影響T 細胞的活化。這與Bernat Olle 的猜想一致。Vedanta 公司已經證明,共生細菌混合物必須是活的,因為這樣才能正常產生代謝產物和信號,從而起效。
但是在這個過程中有許多步驟的機制尚不清楚:微生物是直接還是間接地向T 細胞發送信號?微生物組還會影響其他哪些類型的T 細胞(輔助T 細胞或T 調節細胞)?一旦T 細胞在腸道中被完全激活,它們是如何找到進入並浸潤腫瘤的途徑呢?
Khoruts 解釋說,微生物產生的T 細胞群和被激活的T 細胞群之間存在幾個黑匣子的原因之一是,從患者體內提取T 細胞群並對其進行研究是極其困難的。
另一批研究人員進一步推進了該理論,他們認為在腸道中發現的大量微生物產物中,有些可能模仿腫瘤抗原,並更直接地產生靶向腫瘤的T 細胞群。
“我們相信腸道是T 細胞的儲存庫,它可以識別模仿腫瘤抗原的細菌抗原。”法國巴黎Enterome 公司的首席科學官Christophe Bonny 說。
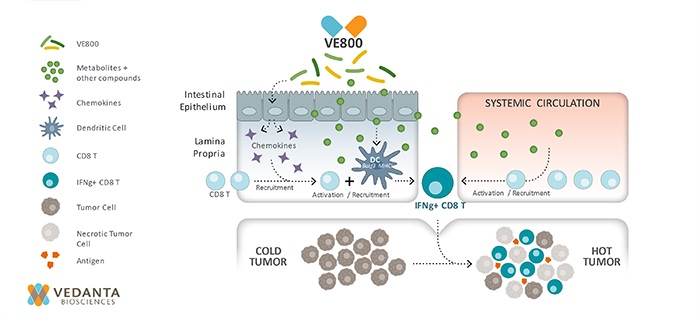
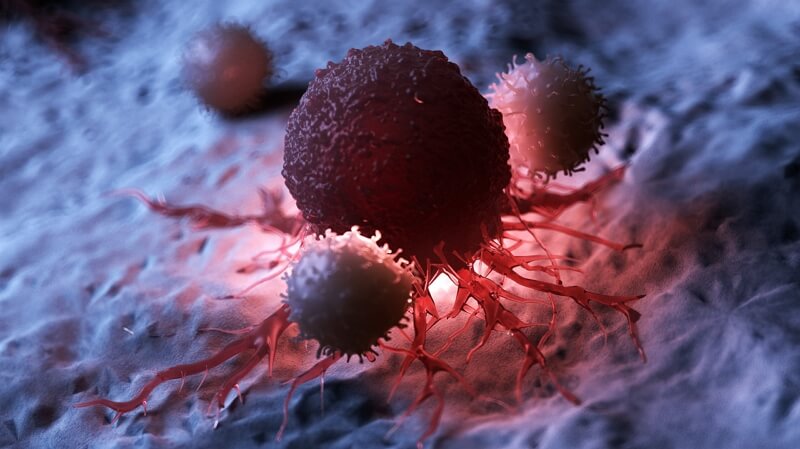
圖.當腸道上皮細胞對某些微生物(VE800,如圖所示)產生趨化因子或細胞因子信號來招募T 細胞時,T 細胞就會被激活,很可能是被腸道中的抗原呈遞樹突狀細胞所激活。當有足夠的陽性免疫信號發生時,T 細胞就會完全激活CD8+ 細胞毒性T 細胞,增殖,並尋找之前隱藏的或在肆虐的腫瘤細胞,用乾擾素和顆粒酶等分子毒害它們。
基於微生物組的藥物
現在,這場競賽正在積極開發和試驗基於微生物的方法,旨在將癌症患者轉化為CPI 響應者。“這就是殺手鐧,” Highlander 說,“以藥丸形式添加混合細菌,把患者變成良好的CPI 響應者。”她預測,可能會有很多成功的產品實現這一目標。“我們從人類微生物組項目中了解到,人們可以擁有非常不同的微生物群落組成,但它們在功能上是相同的。”
她參與了CBM588 與CPI 的聯合治療的試驗,其中CBM588 是一種丁酸梭狀芽孢桿菌的結晶形式。這種細菌產生丁酸鹽(一種短鏈脂肪酸),被認為可以促進某些雙歧桿菌(響應者菌群中發現的一種)的生長。
Vedanta 公司根據Honda 的研究成果開發了一種純化的、冷凍乾燥的11 種細菌的混合物VE800。它可以激活產生干擾素-γ 的細胞毒性T 細胞[3]。
目前該公司正在晚期大腸癌、胃癌和黑色素瘤患者中進行該藥物與CPI nivolumab 聯用的試驗。在試驗過程中,Vedanta 公司計劃對患者的糞便樣本進行測序,以查看VE800 菌株是否在腸道內定殖,並確定定殖的程度如何。
位於馬薩諸塞州劍橋市的Seres Therapeutics 公司正在試驗另一種細菌聯合候選藥物,SER-401,在轉移性黑色素瘤患者中與nivolumab 聯合使用。SER-401 包含從健康供體糞便中分離純化得到的菌株,患者將從CPI 療程開始前每天服用,持續8 週以上。
該藥物的設計基於與德克薩斯州休斯頓MD 安德森癌症中心的Jennifer Wargo 合作研究,該研究揭示了與CPI 響應相關的菌株的關鍵特徵,包括來自Ruminococcaceae 科的細菌[8],Seres Therapeutics 公司的執行副總裁和首席信息官Matthew Henn 說。
Khoruts 和微生物菌群療法計劃(Microbiota Therapeutics Program)正在試驗一種名為MTP101 的“藥丸中的FMT”配方,並與CPI durvalumab 聯合使用,以治療非小細胞肺癌。與Vedanta 和Seres 公司的候選藥物相比,MTP101 是由健康的供體糞便中純化和凍乾的整個微生物組組成。
Khoruts 表示,像他的試驗,使用類似FMT 的全微生物組藥丸之類的試驗,應該與其他縮小到少數菌株的方法同時進行。“我們可以相互學習,也可以從彼此的數據中學習。”Khoruts 說。
科羅拉多大學奧舒拉分校安舒茲醫學院的醫學腫瘤學家Ryan Weight 說,膠囊化細菌混合物是否真的會在癌症患者的腸道內定殖是一個懸而未決的問題。對於其他類型的患者也是如此,尚未證明“藥丸中的FMT”產品能定殖於人的腸道,並且FMT 如何隨時間改變艱難梭菌感染患者的腸道菌群尚有待商榷。
“所有這些都屬於醫生尚未使用的一類療法。” Khoruts 說。他還補充道,評估這些藥物的配方、劑量、體內路徑和藥效學是一個全新的藥理學領域。
Khoruts 指出,這些方法與使用FMT 治療艱難梭菌感染也有很大不同,因為艱難酸菌感染的患者的天然微生物菌群已被大量的抗生素幾乎清除掉了。這就好比一塊田地被除草劑和化肥摧毀了,卻還指望它能長出健康的莊稼。而癌症患者通常仍然擁有自己完整的土著微生物組,因此,更像是試圖用一些有益物種來管理已經建立的草原。
Weight 說,同樣有可能的是不同類型的腫瘤可能需要不同種類的腸道細菌來激活T 細胞抵抗那些特定的腫瘤。“到2040 年,我們可能會擁有一個針對結腸癌的益生菌雞尾酒。”

挖掘微生物組中的抗原
根據腫瘤抗原模擬物的想法,Enterome 採取了一種完全不同的方法。最近,該公司及其合作者發表了通過對8,000 多人腸道微生物組進行測序而得到的2000 萬個基因,這來自於4,600 多種微生物[9]。Bonny 說:“微生物組的魅力在於,深入研究這個擁有2000 萬個基因產物的庫就像走進亞馬遜叢林,在豐富的生物中尋找藥物一樣。”
為了篩選出2,000 萬種細菌產物中哪些可能對CPI 響應者的免疫應答負責,Enterome 在數據集上運行了幾次生物信息學過濾器,得到了一個包含20000 種蛋白質的“短列表”。這是細菌可能會分泌的類似細胞因子、趨化因子或激素的小分子,它們可能會與人類細胞受體相互作用。
接下來,Enterome 將會在這些細菌肽中搜尋以尋找類似於特定腫瘤抗原的分子,例如由膠質母細胞瘤腫瘤唯一表達的IL-13Rα2。目前,Enterome 鑑定出了三種細菌抗原,並將其放入其疫苗產品EO2401 中,以期喚醒識別這些抗原的T 細胞。
在臨床試驗中,膠質母細胞瘤患者在CPI 治療的最初幾個月中,每三週進行一次疫苗接種。“如果我們正確的話,我們可以靶向已經見過這些微生物抗原的記憶T 細胞群,” Bonny 說,“因此,我們預計它會很快就能找到。”
潛在陷阱中許下承諾
Weight 說,過去五年在該領域的工作已經表明,腫瘤學家“需要關注這種複雜的相互作用是如何在患者治療中發揮作用的”。在他的實踐中,這意味著建議患者在開始CPI 治療之前的6~8 週內盡可能不服用抗生素,更令人驚訝的是,Weight 還建議他的患者在此階段不要服用非處方益生菌。據Weight 說,沒有證據表明益生菌會提高CPI 治療的功效。事實上,這些高度精選的菌株可能會破壞患者起到保護作用的天然微生物組。
Sumanta Pal 還警告說,研究人員需要更好地了解微生物組如何影響免疫療法。他說:“在我們向患者提供強化Akk 菌的產品之前,我們需要確定Akk 菌真的是關鍵因素。”
在這個令人難以置信的複雜空間中,研究人員還有許多問題需要回答。
Khoruts 說:“免疫腫瘤學是癌症研究中的巨大突破,”他提到前總統Jimmy Carter 因CPI 治療而活著。他指出,微生物組腫瘤學領域處於非常早期的階段,有許多不同的想法可以追尋,候選者需要通過試驗驗證。
他說:“即使在最佳情況下,也只有40%的患者對CPI 有所響應。作為一個領域,我們還有很大的提升空間。”
參考文獻:
1.S. Viaud et al., Science 342, 971–976. (2013), doi: 10.1126/science.1240537.
2.M. Vétizou et al., Science 350, 1079–1084, (2015), doi: 10.1126/science.aad1329.
3.T. Tanoue et al., Nature 565, 600–605, https://doi.org/10.1038/s41586-019-0878-z.
4.L. Derosa et al., J. Clin. Oncol. 35, 3015 (2017).
5.BE Wilson, B. Routy, A. Nagrial, V. T .Chin, Cancer Immunol. Immunother. 69, 343–354 (2020), https://doi.org/10.1007/s00262-019-02453-2 .
6.T. Hagan et al., Cell 178, 1313–1328 (2019), https://doi.org/10.1016/j.cell.2019.08.010.
7.NJ Salgia et al., Eur. Urol. 78, 498–502 (2020), https://doi.org/10.1016/j.eururo.2020.07.011.
8.V. Gopalakrishnan et al., Science 359, 97-103 (2018), doi: 10.1126/science.aan4236.
9.A. Almeida et al., Nat. Biotechnol. (2020), https://doi.org/10.1038/s41587-020-0603-3.
原文鏈接:https://www.sciencemag.org/features/2020/11/can-patients-gut-microbes-help-fight-cancer
作者|Kendall Powell
編譯|Jack Chen
資料來源出處: 熱心腸先生